UE质粒小量制备试剂盒
产品货号: UE-MN-P-50/UE-MN-P-250/UE-MN-P-500
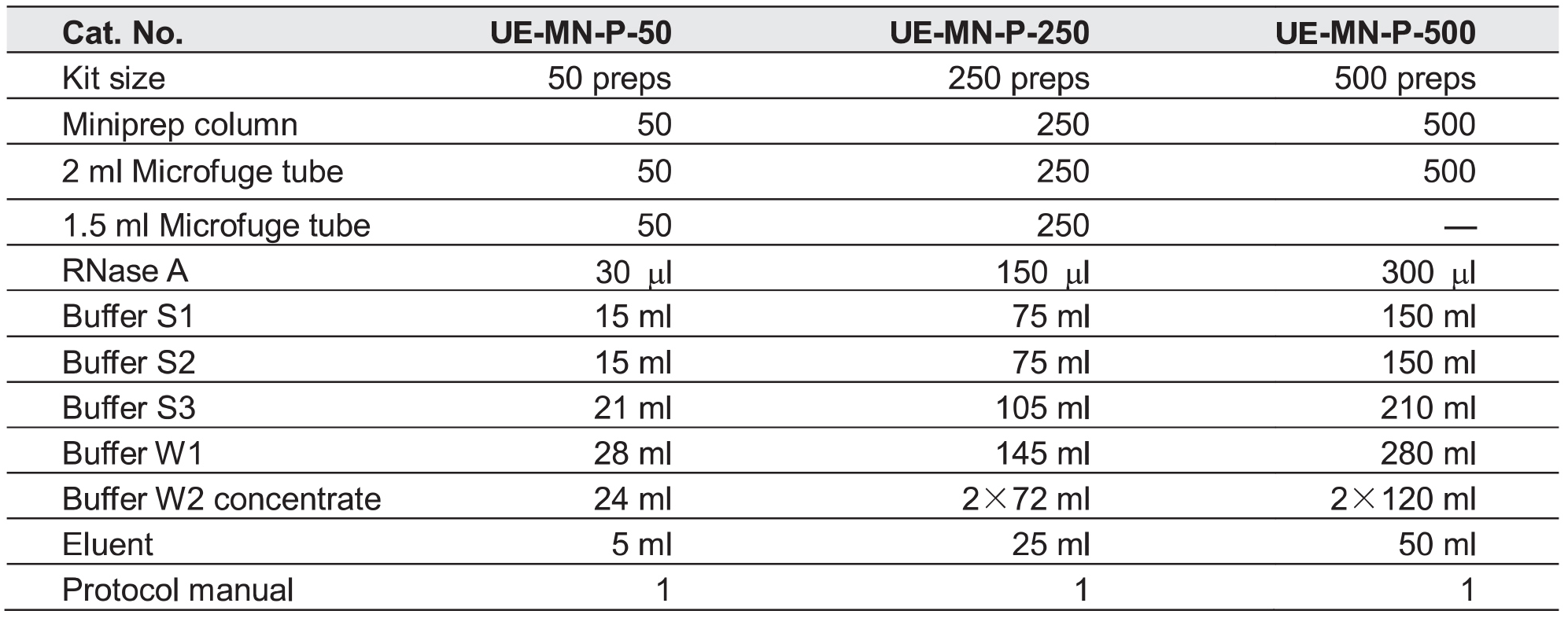
产品规格: 50T/250T/500T
目录价(元):283/1271.2/2224.5
大包装询价
产品概述:
储存条件
RNase A: 50 mg/ml, 室温可贮存6个月,长期贮存于-20℃。
Buffer S1: 细菌悬浮液。加入RNaseA后,混合均匀,4℃贮存。
Buffer S2: 细菌裂解液(含SDS/NaOH), 室温密闭贮存。
Buffer S3: 中和液,室温密闭贮存。
BufferW1: 洗涤液,室温密闭贮存。
Buffer W2 concentrate: 去盐液。使用前,按试剂瓶上指定的体积加入无水乙醇(可用100%乙醇或95%乙醇)。混合均匀,室温密闭贮存。
Eluent: 洗脱液,室温密闭贮存。
流程图

说明书:
 UE-UE-MN-P-50/UE-MN-P-250/UE-MN-P-500
UE-UE-MN-P-50/UE-MN-P-250/UE-MN-P-500
常见问题解答:
◆同样体积的新鲜菌液,为什么有些提取的质粒浓度高,而有些质粒的浓度低?这些情况应该如何处理?
质粒提取高低的一个重要决定性因素是质粒载体的拷贝数,即质粒在一个大肠杆菌中的数目。对于低拷贝数的质粒,需要适当增加菌液的收集量,详情请参阅说明书。
以下是几种常见载体的拷贝数:

◆请问能否使用UE质粒小量制备试剂盒、UE-96质粒DNA试剂盒提取BAC之类的大质粒?
不建议使用。对于大质粒的提取,推荐您选择UE Easy-96质粒试剂盒。
◆使用UE质粒小量制备试剂盒,加入Buffer S3后沉淀不明显。请问是什么原因?
一种可能是菌体太少,所以没有明显沉淀,建议增加菌体使用量。另外一种可能是加入Buffer S3后没有充分混匀,建议加入Buffer S1后完全重悬菌体,加入Buffer S2后轻轻混匀,使菌体完全裂解,加入Buffer S3后充分混匀。
◆UE质粒小量制备试剂盒中的制备管能否与UE DNA凝胶回收试剂盒中的制备管替换使用?
不能。两种制备管都是基于硅胶膜技术,但是各自的制备管只有与各自试剂盒中的试剂盒配套才能达到最佳效果。质粒小量试剂盒结合能力最大为20µg,最长的质粒片段为50kb。胶回收试剂盒最大结合能力为8µg,最长的DNA结合片段为10kb。
◆我提取的质粒为什么会有基因组条带?
菌体在裂解和中和过程中如果操作过于剧烈就容易引起基因组污染。加入Buffer S2后要轻柔混匀,加入Buffer S3后混合均匀。如果发现裂解物在操作过程中过于黏稠,需要适当降低菌体的用量。
◆我提取的质粒在电泳图片上看,有一条紧挨着主带的小条带请问这是什么原因?如何判定它是否是杂带?
那条带很有可能就是变性条带。如果在加入Buffer S2后没有及时混匀菌体,会导致菌体局部碱性过强,破坏质粒的结构,在加入Buffer S3后质粒无法完全复性,就产生了这样的变性条带。
检测的方式是通过酶切检测,如果这条带在酶切后依然存在,则是变性条带,如果酶切后消失,则可能是质粒的不同状态。
◆我提取的质粒有明显的RNA污染,请问是什么原因?
可能有以下两种可能:
1、RNase A活力下降。Buffer S1在加入RNase A后要保存在4℃冰箱。如果室温放置,RNase A活力会下降,导致RNA污染。
2、菌体过量。如果使用的菌体量过多,也可能导致RNA污染。适当减少菌体的用量。
◆质粒得率很低,请问是什么原因?
质粒低的可能因素很多,以下是几种可能原因:
1、菌体过量,导致菌体不能完全裂解和中和,最终导致质粒得率低。
2、Buffer W2中未按瓶子上得标注体积加入乙醇。
3、菌体老化,影响提取的效果。建议对菌液进行划板培养,筛选新鲜克隆。
◆请问Eluent Buffer的配方是什么?对于DNA测序有没有影响?
Eluent Buffer 的配方是2.5mM Tris-HCl,pH8.0。质粒在这样的溶液中能够稳定保存,而且测序不受影响。
