无需预孵育!导入细胞质的蛋白转染试剂蛋白研究-wako富士胶片和光
| 供货周期 | 一个月以上 | 应用领域 | 医疗卫生,生物产业 |
|---|
无需预孵育!导入细胞质的蛋白转染试剂
ProteoCarry <Protein Transfection Reagent>
本产品是将蛋白以及葡聚糖等生物大分子导入细胞内,尤其是导入细胞质的试剂。传统的蛋白转染试剂存在蛋白滞留在内体或溶酶体中的问题,但是由于本产品可以高效地将蛋白运送至细胞质,可以广泛地适用于在评价导入蛋白的细胞内功能和抗体导入引起的功能抑制诱导等的实验。

无需预孵育!导入细胞质的蛋白转染试剂
ProteoCarry <Protein Transfection Reagent>
本产品是将蛋白以及葡聚糖等生物大分子导入细胞内,尤其是导入细胞质的试剂。传统的蛋白转染试剂存在蛋白滞留在内体或溶酶体中的问题,但是由于本产品可以高效地将蛋白运送至细胞质,可以广泛地适用于在评价导入蛋白的细胞内功能和抗体导入引起的功能抑制诱导等的实验。另外与传统产品不同的是,本品无需与蛋白进行预孵育,所以不会形成复合体,低限度地限制其对蛋白功能的影响。
※本产品仅供研究,研究以外请勿使用。
◆蛋白转染试剂及其问题
蛋白转染试剂(Proteofection试剂)是将重组蛋白和抗体直接导入细胞的工具。与将质粒导入以诱导表达目的蛋白的方法相比,可以更迅速地导入目的蛋白,因而受到了广泛地关注。
虽然已经开发了许多基于肽、阳离子的脂质或聚合物的蛋白转染试剂,但它们都是与蛋白形成复合物后,通过胞吞作用摄入细胞内,破坏内体膜将其运送至细胞质。然而,现有的大部分试剂内体膜的破坏活性低,并且从内体逃脱不足,导入的蛋白大部分都转移至溶酶体降解系统。本产品是一种新型肽蛋白转染试剂,克服了传统的蛋白转染试剂的缺点,通过强有力的内体膜选择性破坏活性,高效地向细胞质运送蛋白,使转导的蛋白在细胞内发挥活性。另外,与传统的蛋白转染试剂不同,本品无需与蛋白的复合物,不仅仅是蛋白,还可以向细胞质导入生物大分子(葡聚糖等)。
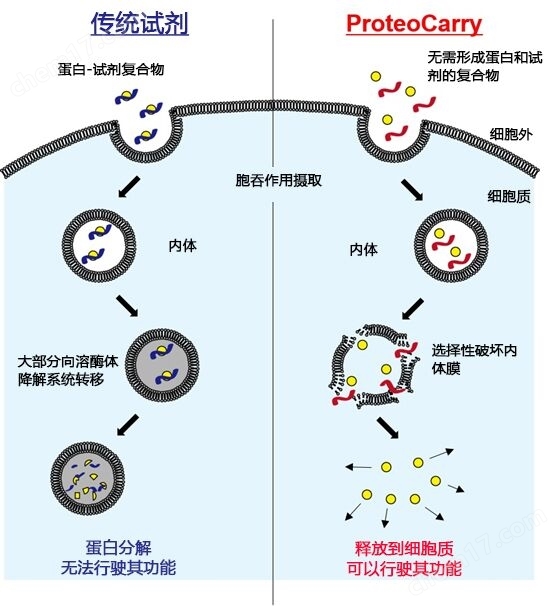
图1. 细胞导入原理的比较
图2是导入荧光标记IgG的案例。不添加转染试剂时,以内体/溶酶体的染色为主,从细胞质中无法获得荧光信号,与之相对的,可以观察到在本产品案例中,内体、细胞质被大面积染色。(详情请参照应用实例)
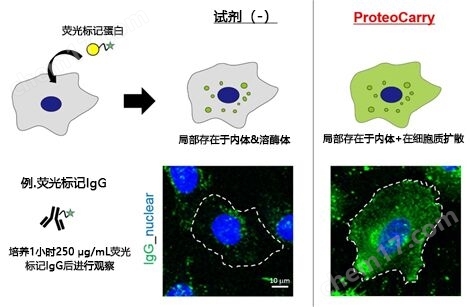
图2. 向HeLa细胞导入荧光标记IgG的比较
◆特点
● 基于肽特性的蛋白转染试剂,显示出高度水溶性。
● 优异的内体膜破坏活性,与传统方法相比显示出高细胞质传达性。
● 无需与导入物质进行预孵育,可以简便且迅速地转染。
● 由于不会与蛋白形成复合物,所以需要添加浓度较高的蛋白,但是可以低限度地抑制对蛋白功能的影响。
● 只需要1小时的处理就可以充分地转染至细胞质。
● 有无血清(<10% FBS)不会影响导入效率,可以根据想要使用的细胞设计实验。
● 已有向细胞质导入各种蛋白及生物大分子的应用实例。
● 例:IgG抗体、功能性蛋白(Cre recombinase, Saponin)、多糖(葡聚糖)
● 推荐使用浓度几乎没有细胞毒性。
◆使用方法概述
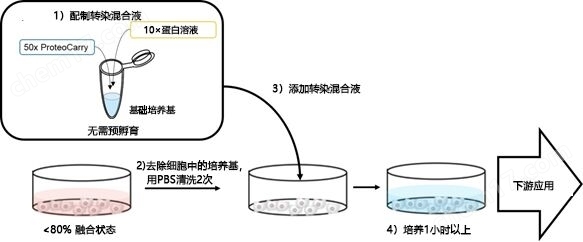
1. 向新鲜的培养基(无血清培养基,10%以下含FBS培养基或PBS)添加本产品以及想要导入的蛋白。
1. (配制转染混合液)。
1. ※无需预孵育
2. 用PBS清洗2次细胞(80%以下的融合状态)后,向细胞添加转染混合液。
3. 在转染混合液中培养细胞(~1h)
4. 用PBS清洗2次细胞后,添加新鲜的培养基。
5. 实现各项应用。
◆试剂盒组成
● ProteoCarry(4 mg)
● FITC-dextran(2 mg,阳性对照用)
实验次数的预测
|
孔板的尺寸 |
ProteoCarry |
FITC-dextran |
|
6 well |
14 assays |
5 assays |
|
12 well |
28 assays |
10 assays |
|
24 well |
56 assays |
20 assays |
|
48 well |
140 assays |
50 assays |
|
96 well |
280 assays |
100 assays |
◆有导入数据的细胞
HeLa, SW280, COS7, NIH3T3, HUVEC
参考导入量
|
导入物 |
推荐培养基的终浓度 |
|
|
抗体 |
50~250 μg/mL |
|
|
蛋白 |
Saponin |
1~10 μg/mL |
|
Cre recombinase |
10~100 μg/mL |
|
|
FITC-dextran |
200 μg/mL |
|
※导入效率根据细胞类型,细胞数量和蛋白类型各种因素改变。以上数据仅供参考,建议每次实验都要优化数据。
◆应用实例
1. 向细胞内导入FITC-dextran
向HeLa细胞导入FITC-Dextran(培养基的终浓度为200 μg/mL),仅向细胞添加FITC-Dextran时,(Reagent(-))观察到点状的荧光信号,细胞质中几乎没有观察到信号;相反,使用本产品时扩散到了整个细胞质。
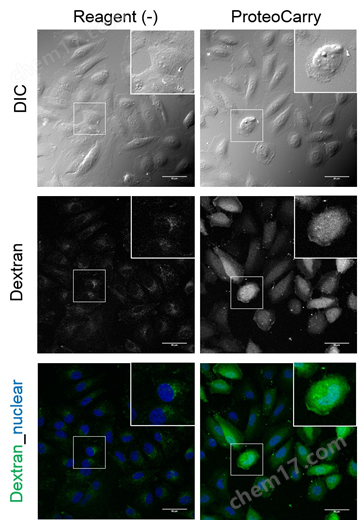
实验概要:
向HeLa细胞(80% confluent)添加200 μg/mL FITC-dextran, 1×ProteoCarry in α-MEM,并培养1个小时。用PBS清洗细胞后,进行核染色(Hoechst)。
2. 向细胞内导入荧光标记IgG
向HeLa细胞导入荧光标记IgG抗体(培养基终浓度为250 μg/mL),仅有抗体添加至细胞时,可以观察到胞吞作用自发性摄入点状的荧光信号,表明抗体停留在内体和溶酶体中。另一方面,使用本产品时,不仅能观察到点状的内体结构,还可以观察到它主要在细胞质中广泛扩散。
※用荧光信号观察细胞扩散时,与内体相比,由于细胞质的体积较大,信号会被稀释。细胞质信号的检测需要添加高浓度的荧光标记蛋白,在本数据中添加了250 μg/mL的荧光标记IgG。

实验概要:
向HeLa细胞(80% confluent)添加250 μg/mL荧光标记IgG,1×ProteoCarry in α-MEM并培养1小时。用PBS清洗细胞后,进行核染色(Hoechst)。
3. 向细胞内导入Cre recombinase
将设计为Cre recombinase不存在时表达DsRed,只有在Cre recombinase存在时发生重组表达GFP的质粒向HeLa细胞导入基因。相对于导入第二天就表达DsRed的HeLa细胞,使用本产品导入Cre recombinase(培养基终浓度为10 μM),依赖导入细胞内的Cre recombinase表达GFP,本产品在维持Cre recombinase的功能下将其导入了细胞。
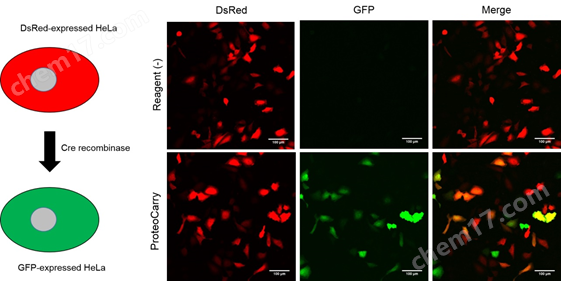
实验概要:
向HeLa细胞转染质粒的第二天,向HeLa细胞添加10 μM Cre recombinase, 1×ProteoCarry in α-MEM,并培养1小时。用PBS清洗细胞后,用新的培养基再培养24小时。
◆保存
● 运输:室温
● 保存:-20℃
◆产品列表
| 产品编号 | 产品名称 | 包装 |
| FDV-0015 |
ProteoCarry<Protein Transfection Reagent> ProteoCarry <蛋白质转染试剂> |
1 set |
