293T细胞残留DNA(qPCR)检测试剂盒描述检验原理产品组成用途说明使用方法储存/保存方法注意事项
| 概述 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 描述 |
随着基因细胞治疗的快速发展,多种病毒载体被用于基因细胞治疗,这些载体大都使用293系列细胞(如:HEK293, 293T等)进行生产,这就导致293系列细胞残留DNA会作为杂质存在于载体终产品中。由于宿主细胞DNA的稳定性,容易在生产过程中产生残留,而这些生物制品应用到人类疾病治疗时,会带来不可控危险因素。因此宿主核酸残留一项是各类质控标准必检项, 必须遵循WHO、FDA以及我国NMPA监管条例,确保宿主核酸残留在安全可控范围内。
293T细胞残留DNA检测试剂盒专一性强,能快速、特异地检测生物制品和基因细胞治疗产品中293T细胞的DNA残留。 建议所有使用该试剂盒的实验室按需可做以下验证:标准品线性、 样本线性、 准确度(加标回收率)、定量限、精密度(重复性)、 分析特异性以及阴性参考品符合率。 样本线性:依据 YY/T 1182-2020 的相关要求,在线性范围内,取接近线性范围上限的高值样本按一定比例(如 5 倍或 10 倍)稀释为至少 5 种浓度,其中低值浓度样本须接近线性范围的下限,将每一浓度样本检测 1 次或多次,计算每一浓度的对数均值和稀释比例(或理论浓度)的对数值,以浓度的对数均值为 Y,稀释比例(或理论浓度)的对数值为 X 进行线性拟合,计算其线性相关系数 r。 分析特异性验证:验证需避免工艺杂质对检测结果的干扰,必要时可对样本进行核酸提取纯化。为避免基质干扰和保证检测有效性建议使用纯度较高的 DNA 进行相应稀释后来做验证。 精密度/定量限:验证时,如需同时配制标曲,需控制 CV,避免重复操作过多,CV 偏大影响标曲建立和精密度/定量限验证。 数据分析:由于仪器不同,数据阈值线会存在区别,故在数据分析时需依据实际情况统一阈值线再进行数据分析比较。 样本核酸提取纯化:可与“宿主细胞残留 DNA(磁珠法)样本前处理试剂盒”配合使用。该试剂盒主要用于生物制品样本中微量核酸的提取,可精准抽提各种生物制品中宿主细胞残留 DNA,适 用于多种基质缓冲溶液,可有效提取纯化微量的 DNA。 产品特点: 精密度高:低浓度重复性CV值<20%;中高浓度重复性CV值<15% 线性标准:依据国标的基本要求,各项指标全,标准高,结果稳定可靠 快速高效:检测快速,一小时即可出结果 产品性能指标: 线性范围:300pg/µL~0.03pg/µL; 标准品线性:R2≥0.980,扩增效率 90%≤Eff(%)≤110%,各浓度检测值 CV<15%。 准确度(加标回收率):70%-130%。 定量限:0.03pg/µL,CV≤20%,测量偏差不大于|±20%|。 精密度(重复性):高、中两个浓度参考品各 10次,变异系数CV<15%。 分析特异性:考察生物制品生产中常用的 DNA 对检测试剂盒的干扰,检测均值小于定量限或未检出,判定无干扰。 阴性参考品符合率:比标准曲线中最低点高 2~3 个 Ct 值左右。 适用机型(包括但不限于):LightCycler 480,ABI QuantStudio 3,Bio-Rad CFX Opus96 等。 冻融稳定性:5 次以上。 |
||||||||||||||||||||||||||||||||||||||||||||||||||
| 检验原理 |
依据《美国药典》<509>通则和<1130>以及《中国药典》通则<3407> 中的各种检测方法,最终选择更准确、可靠、科学的荧光探针(TaqMan ®)qPCR 法作为细胞残留 DNA 检测的方法。TaqMan ®荧光探针是一种寡核苷酸探针,其 5’末端携带荧光基团(报告基团),如 FAM、TET、VIC等,3’端携带淬灭基团,如 TAMRA、BHQ1 等。PCR 扩增时在加入一对引物的同时加入一条特异性的荧光探针,探针完整时,荧光基团发射的荧光信号被淬灭基团吸收。PCR 扩增时,Taq 酶的 5’-3’外切酶活性将探针酶切降解,使荧光基团和淬灭荧光基团分离,从而荧光监测系统(荧光定量 PCR 仪)可接收到荧光信号,即每扩增一条 DNA 链,就有一个荧光分子形成,实现了荧光信号的累积与 PCR 产物形成完全同步。该方法具有特异性强、灵敏度高等特点,在目前生物制药细胞核酸残留检测中被广泛使用。
|
||||||||||||||||||||||||||||||||||||||||||||||||||
| 产品组成 |
|
||||||||||||||||||||||||||||||||||||||||||||||||||
| 用途说明 |
本试剂盒配套有 293T DNA 定量参考品可快速准确定量检测各种生物制品(基因细胞治疗的腺相关病毒/慢病毒相关制品、逆转录病毒和蛋白制品等)的中间品、半成品和原液以及成品中 293T 残留 DNA。试剂盒的线性范围为:0.03pg/µL~300pg/µL。
|
||||||||||||||||||||||||||||||||||||||||||||||||||
| 使用方法 |
一、准备工作:
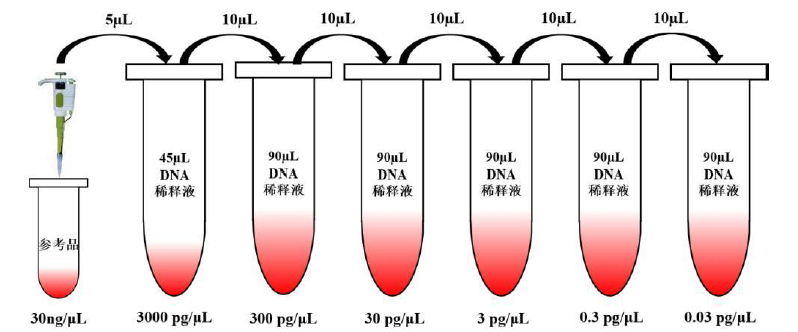
1、试剂盒准备: 将试剂盒各组分置于冰上或 4℃,确保充分溶解后开始操作。 2、需自备的耗材及设备: (1)荧光定量 PCR 仪、涡旋仪、离心机 (2)高精度移液器及一次性无菌无酶低吸附带滤芯吸头(0.5-10µL、10-100µL、20-200µL、100-1000µL) (3)1.5mL 无菌无酶低吸附离心管 (4)无菌无酶八联管或 96 孔 qPCR 板 二、操作流程: 1、操作详细步骤: (1)qPCR 反应液的制备: ①根据所需检测的参考品和待测样品数量(一般做 3 组复孔), 分别计算反应所需孔数: 反应孔数=(参考品 ST1-5+1 个无模板对照 NTC+待测样品)×3 ②根据反应孔数计算本次所需的 qPCR MIX 总量: qPCR MIX =(反应孔数+2 或 3)×15μL(2×qPCR Reaction MIX)+ (反应孔数+2 或 3)×5μL(293T Primer&Probe MIX)(2 或 3 为操作损失量) ③将所用试剂置于冰上完全溶解,轻微振荡混匀,瞬时离心,按下表所示配制: 表 2 qPCR MIX 配制表
④将配制的 qPCR MIX,轻微振荡混匀,瞬时离心,按 20μL/孔分装至八联管或者 96 孔板中。
【注】:标准曲线浓度点可根据实际验证结果进行选择,应至少包含 5 个浓度点。 表 4 MIX 各反应孔加样示例
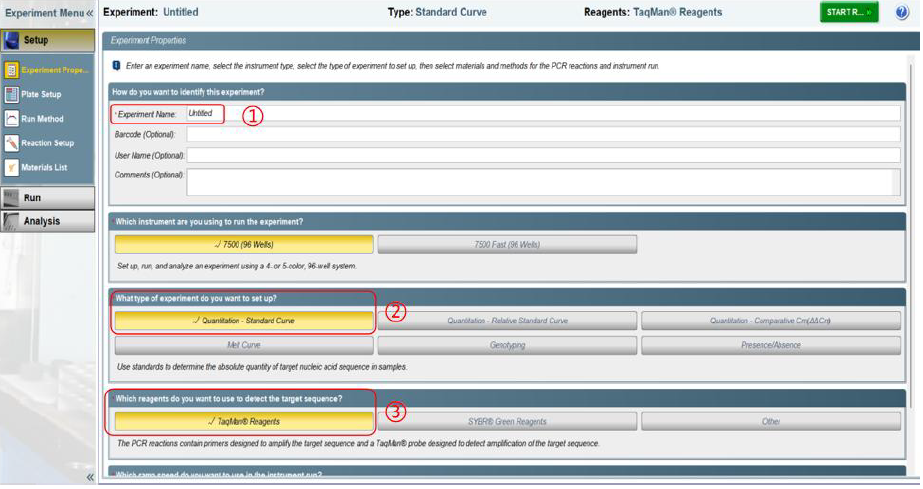
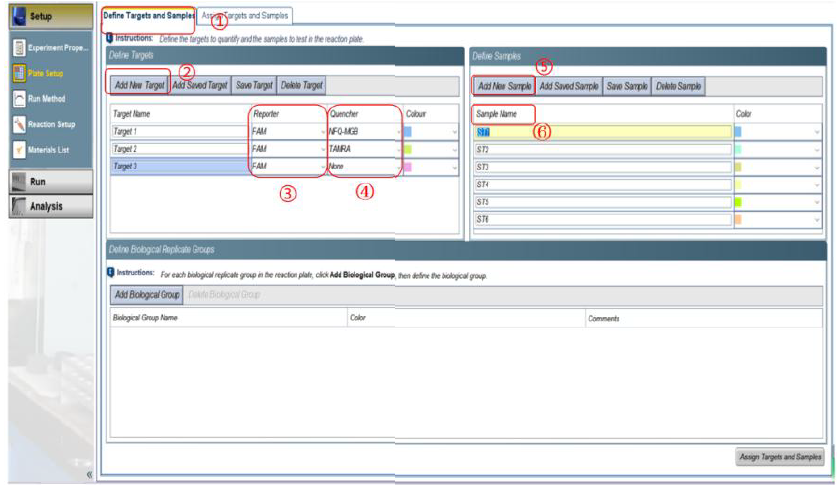
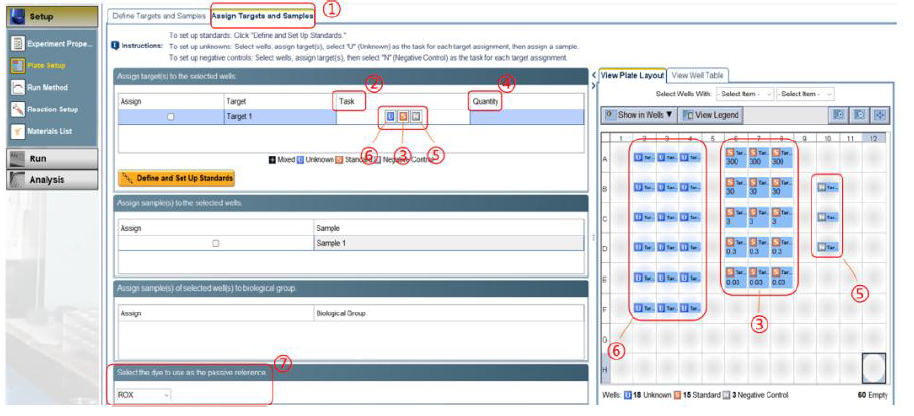
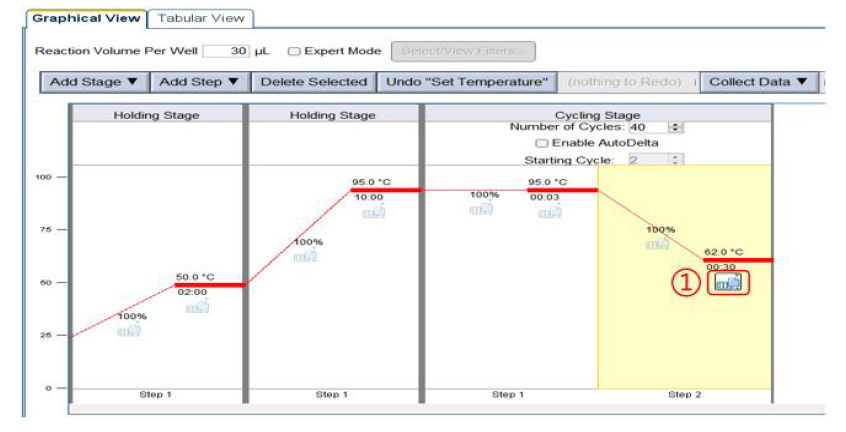
②实验可使用无菌无酶的八联管或者 96 孔板进行反应,需去除反应体系中的气泡,并离心至管底准备反应。 ①Experiment name:修改实验名称。 3) 在 Plate Setup 4) 设 置 反 应 程 序 :
三、结果分析: 2、结果分析的参数设置需依据具体的机型及使用的软件版本,一般也可由仪器自动判读。 |
||||||||||||||||||||||||||||||||||||||||||||||||||
| 性能 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 储存/保存方法 |
试剂盒应在-20℃条件下保存,有效期为 12 个月。开封后未使用完的试剂盒注意仍在规定储存条件下保存。
|
||||||||||||||||||||||||||||||||||||||||||||||||||
| 注意事项 |
1、本试剂盒已通过稳定性(冻融等因素)的验证,无需分装。
2、阴性样品(2×qPCR Reaction MIX、Primer&Probe MIX 和 DNA稀释液等)和阳性样品(参考品和待测样品等)的配制和加样环境需区分区域,不可在一个区域内操作,配制人员需穿戴整齐,戴好口罩、手套和穿好洁净服。 3、注意在不同加样步骤间及时更换吸头,避免交叉污染,避免长时开盖,使用移液器移液时,需避免液体挂壁。 4、试剂盒必须在有效期内使用,每次实验均需重新制备相应的标准曲线,不建议不同标准曲线之间混用,不建议不同批次的相关试剂混用。 5、试剂盒内所有组分建议在低温环境融化后使用,且需确保其充分溶解,各组分使用前需充分混匀,以保证试剂的均一性,经混匀的试剂需经短暂离心,以使管壁及盖子上的液体全部集中于管底。若发现DNA 稀释液中有析出物,建议于 37 ℃条件下进行孵育,使 DNA 稀释液完全溶解。 6、只有严格遵守说明书的操作方法,全部使用本试剂盒配套的试剂才能保证最佳检测效果。 7、最终的试验结果与试剂的有效性、操作者的操作方法及试验环境密切相关。 8、公司只对试剂盒本身负责,不对因使用该试剂盒所造成的样本消耗负责,请使用者使用前充分考虑到样本的可能使用量,预留充足的样本。 |