新品活性 Alpha突触核蛋白原纤维和单体
StressMarq 研发出可以直接注射到活体内产生病理反应的活性 alpha 突触核蛋白原纤维,该方法制作疾病模型的时间要远远短于传统的基因改造小鼠、大鼠。通常注射后30天即可见到病理反应,而基因改造模型需要9个月到1年时间。
我们的活性 alpha 突触核蛋白原纤维可以作为“种子”催化更多活性单体形成聚集体沉积。
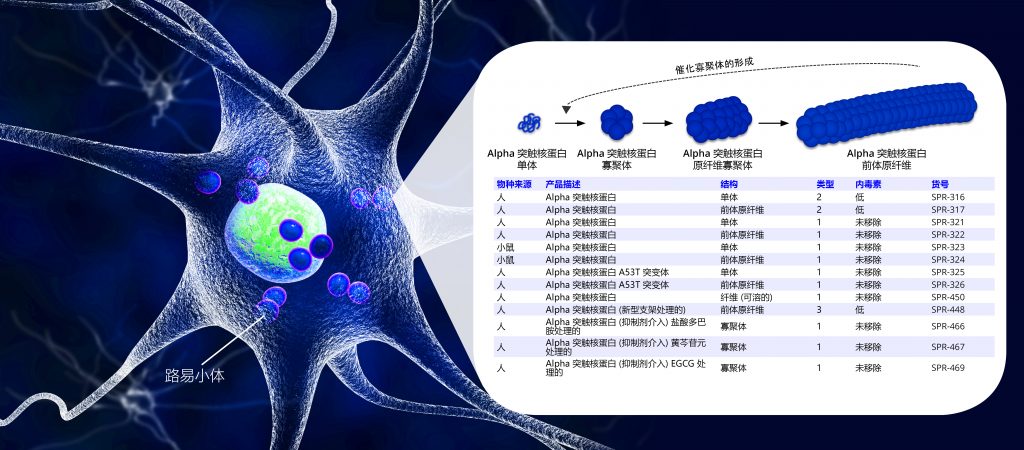
StressMarq 目前提供人源和小鼠源前体原纤维(PFFs)以及单体。所有蛋白都进行了细胞检测和硫黄素T检测。TEM 图片、硫黄素T检测曲线以及其他检测结果可以在产品单页上看到。A53T α-突触核蛋白 单体和 PFFs也上线了。A53T 突变型被认为与早发型帕金森疾病有关并且加速α-突触核蛋白的纤维聚集化。
 |
 |
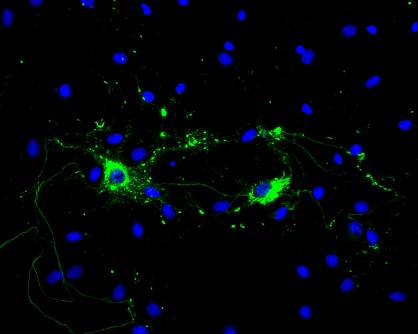
| 大鼠原代海马神经元经过 1 型 小鼠α-突触核蛋白PFFs处理后显示出路易小体病理现象. | 大鼠脑注射了 1 型小鼠α-突触核蛋白 PFFs (SPR-324) 后的 IHC 分析,显示了α-突触核蛋白病理现象. |
StressMarq 目前正在研发更多的原纤维新品用于神经衰退疾病研究,并且也在完善我们现有的产品线。下面表格列出了各种蛋白的区别: Featured Alpha Synuclein Proteins and Antibodies:
|
1 型 PFFs (SPR-322) |
1型 PFFs (SPR-324) |
1 型 PFFs (SPR-326) |
2 型 PFFs (SPR-317) |
3 型 PFFs (SPR-448) |
蛋白纤维 (SPR-450) |
|
|
物种来源 |
人 |
小鼠 |
人 |
人 |
人 |
人 |
|
突变类型 |
野生型 |
野生型 |
A53T |
野生型 |
野生型 |
野生型 |
|
单体来源 |
SPR-321 |
SPR-323 |
SPR-325 |
SPR-316 |
SPR-316 |
SPR-321 |
|
内毒素水平 |
制作时含有内毒素LPS, 并且没有移除 |
制作时含有内毒素LPS, 并且没有移除 |
制作时含有内毒素LPS, 并且没有移除 |
纤维聚集之前移除了LPS (低内毒素) |
纤维聚集之前移除了LPS (低内毒素) |
制作时含有内毒素LPS, 并且没有移除 |
|
硫磺素T 检测 |
与SPR-321 单体混合时荧光强度>12 000 荧光单位 与 SPR-316 单体混合时荧光强度为1300 荧光强度 |
与SPR-323单体混合时荧光强度> 3100 荧光单位 |
与SPR-325单体混合时有28 000 荧光单位 |
与SPR-321单体混合时有3000荧光单位 与SPR-316 单体混合时有400荧光单位 |
调研中 |
调研中 |
|
原代细胞活性 |
在原代大鼠细胞中会诱发路易体病理现象 |
在原代大鼠细胞中会诱发路易体病理现象 |
调研中 |
在原代大鼠细胞中不会诱发路易体病理现象 |
调研中 |
调研中 |
|
活体内活性 |
在大鼠大脑中注射后30天内产生病理反应 |
在大鼠大脑中注射后30天内产生病理反应 |
调研中 |
调研中 |
调研中 |
调研中 |
3 型 PFFs (使用新型支架制作) 与1 型 PFFs 结构和活性都相似,但是内毒素水平较低与2 型 PFFs 相似。 PFFs 不可溶而蛋白纤维可溶,但是可能根据操作手法不同会有少量不溶原纤维。
抑制剂可以停滞alpha突触核蛋白的聚集,阻止寡聚体形成原纤维。以下是抑制剂阻滞的寡聚体:
|
盐酸多巴胺处理的寡聚体 (SPR-466) |
黄芩苷元处理的寡聚体 (SPR-467) |
EGCG 处理的寡聚体 (SPR-469) |
|
|
抑制剂 |
盐酸多巴胺 (Dopamine HCl) |
黄芩苷元 (Baicalein) |
表没食子儿茶素没食子酸酯 (EGCG) |
|
物种来源 |
人 |
人 |
人 |
|
突变类型 |
野生型 |
野生型 |
野生型 |
|
单体来源 |
SPR-321 |
SPR-321 |
SPR-321 |
|
内毒素 |
制作时含有内毒素LPS, 并且没有移除 |
制作时含有内毒素LPS, 并且没有移除 |
制作时含有内毒素LPS, 并且没有移除 |
只含有抑制剂–阻滞的寡聚体的硫磺素T检测在24小时内没有显示荧光强度增强,当与1型单体混合时荧光强度有所增加。 但是这个增加比单独1型单体的增加要少。这说明这些抑制剂–阻滞的寡聚体减缓了单体的聚集。
| 硫黄素 T 是一种荧光染料,可以绑定富含beta折叠的结构, 例如alpha 突触核蛋白原纤维. 抑制剂介入-盐酸多巴胺处理的寡聚体 (SPR-466) 显示的荧光强度和单体 (SPR-321) 相比要少得多。单体和抑制剂介入的寡聚体混合后显示的聚集作用很有限。 |
更多详情请咨询Stressmarq中国代理商-上海金畔生物
