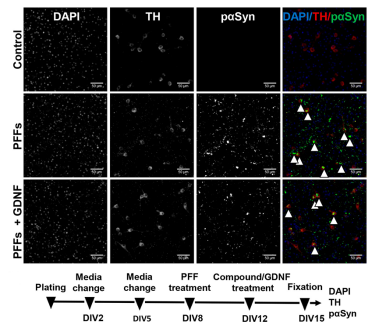
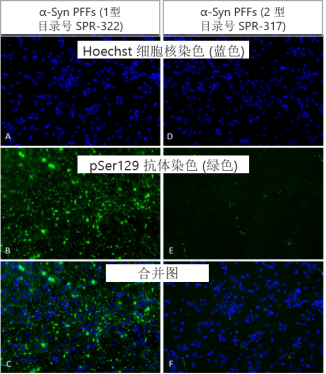
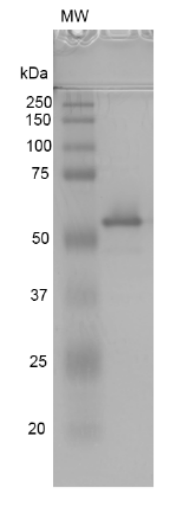
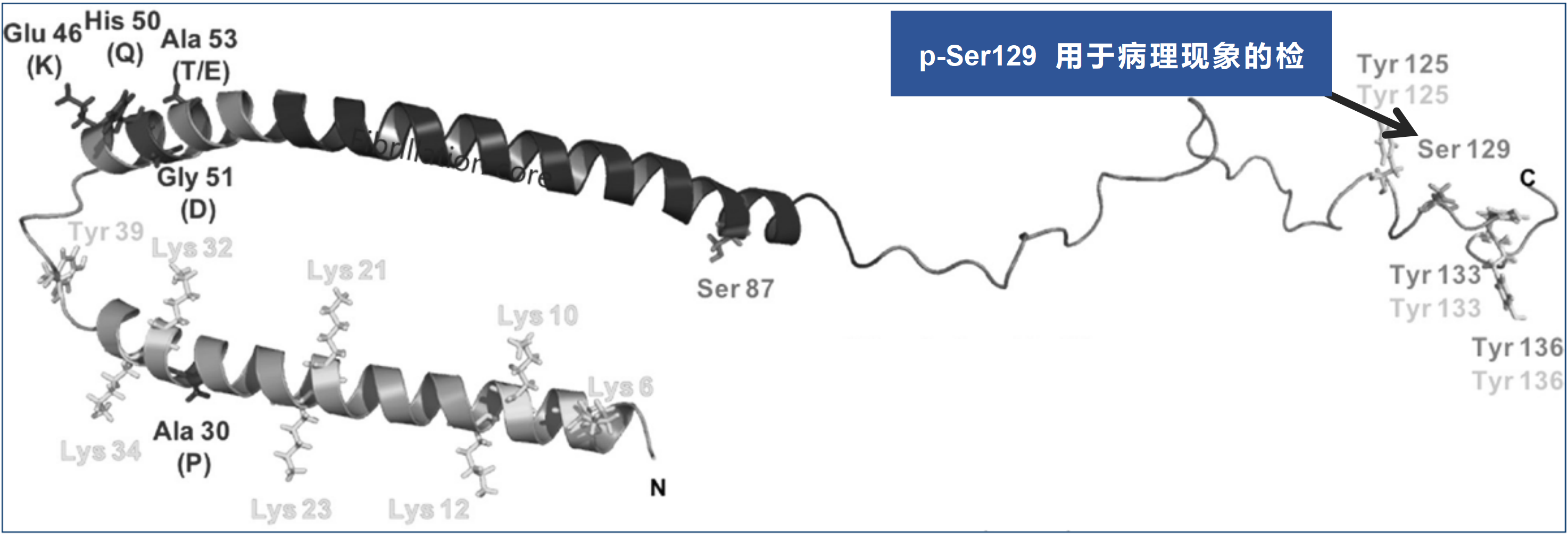
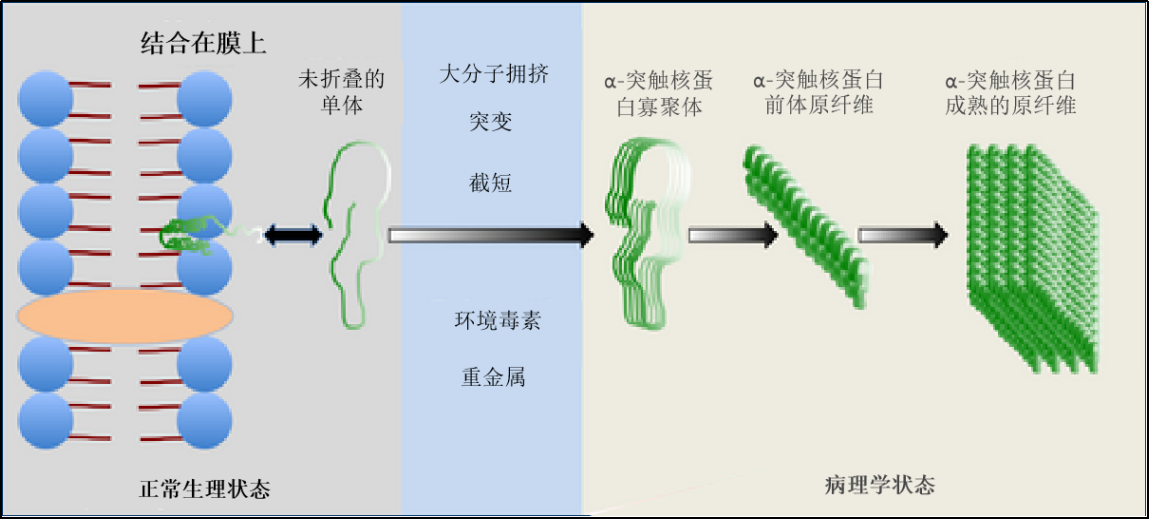
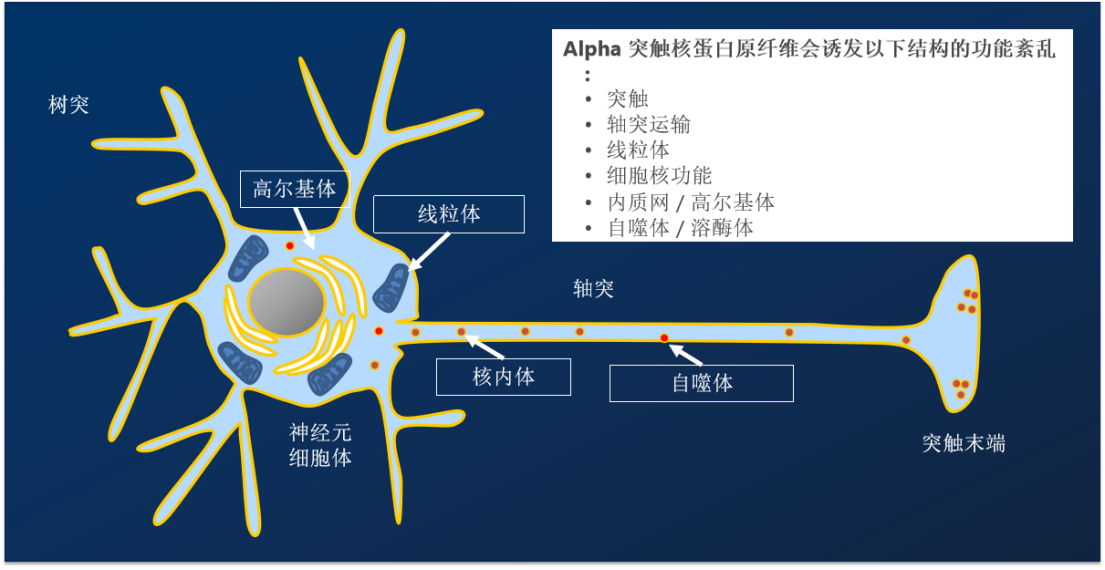
StressMarq——Alpha 突触核蛋白产品推荐(3)
StressMarq——Alpha 突触核蛋白产品推荐(3)
| Alpha 突触核蛋白A53T 突变型PFF |
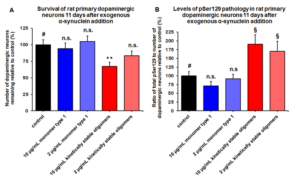
| Alpha 突触核蛋白 A53T PFFs (目录号 SPR-326) 在培养的原代大鼠神经元中诱导丝氨酸 129 磷酸化 |
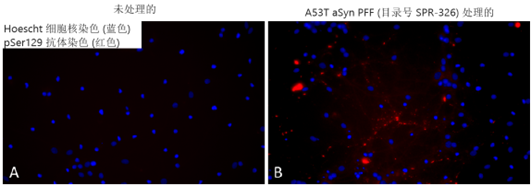 |
| 培养基中 1 µg/ml 超声处理的 StressMarq’s Alpha 突触核蛋白 A53T 突变 PFF(目录号 SPR-326)可诱导原代大鼠神经元中 Ser129 磷酸化。 |
来源: Associate Professor Rehana Leak,Duquesne University, USA
| Alpha 突触核蛋白 S87N 突变型单体和PFF |
| Alpha 突触核蛋白 S87N 突变型 PFF (目录号 SPR-500) 显示在小鼠神经元培养物中增强 α-syn 病理学诱导作用,其效果优于人源和小鼠源野生型原纤维。 |
|

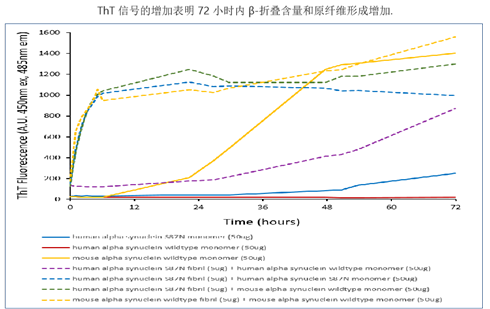
|
| Alpha 突触核蛋白 S129A 突变型单体和 |
| Alpha Synuclein S129A 突变型单体(目录号 SPR-505)和 PFF(目录号 SPR-506)在 129 位不能被磷酸化,因此可用于研究不依赖于磷酸化 S129 的生理特性和病理学。此外,该材料可用于确认疾病模型中内源性 pS129 病理学的诱导情况。 |
|

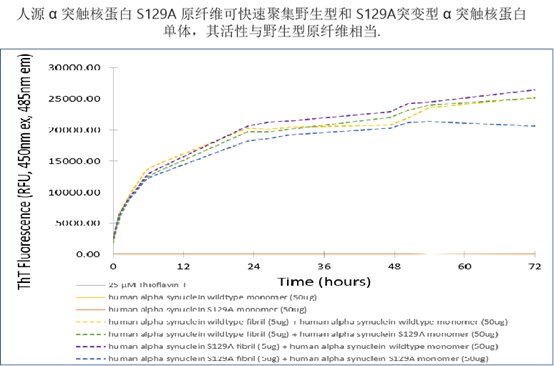
|
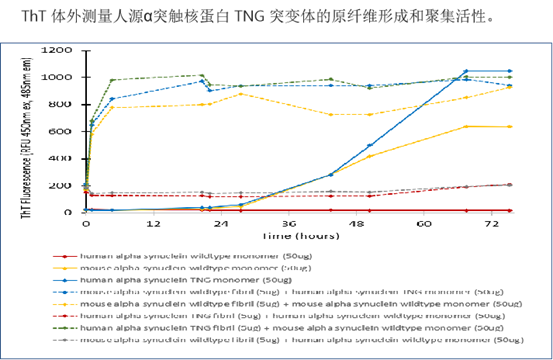
| Alpha 突触核蛋白 TNG (A53T, S87N, N103G) 突变型 |
|
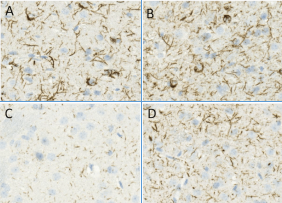
单侧注射到小鼠背侧纹状体后,嵌合型 TNG 原纤维(目录# SPR-504)显示出比人源野生型和小鼠源野生型原纤维更强的 α-syn 病理学诱导现象。人源 TNG 是在野生型小鼠中诱导强大的内源 α-syn 接种和病理学的良好构建体。
|
|
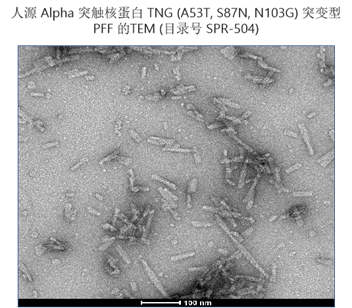
|
| 氨基末端乙酰化的 Alpha 突触核蛋白PFF |
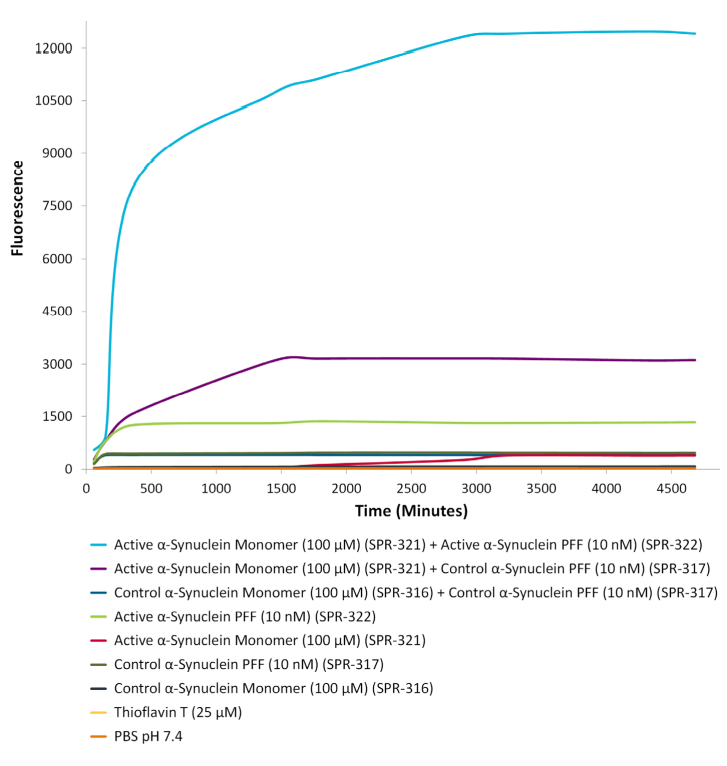
| 硫磺素T检测显示氨基末端乙酰化的 Alpha 突触核蛋白PFFs (目录号 SPR-332) 聚集氨基末端乙酰化的Alpha 突触核蛋白单体 (目录号 SPR-331)。 |
|

来源: University of Toronto, Canada

来源: StressMarq Biosciences; internal results
|
| 大鼠 Alpha 突触核蛋白 |
| StressMarq的大鼠Alpha 突触核蛋白PFF(目录号 SPR-482) 在硫磺素T聚集测试中显示出聚集特性。 |
|
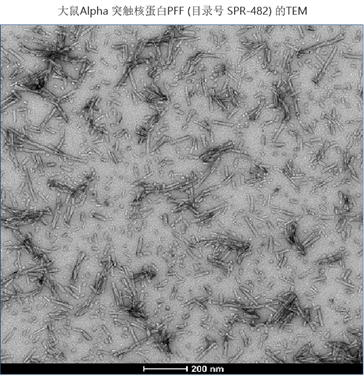
来源: University of Toronto, Canada
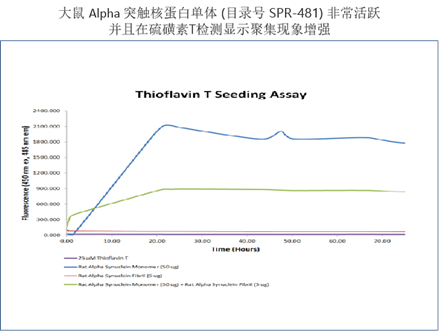
来源: StressMarq Biosciences; internal results
|
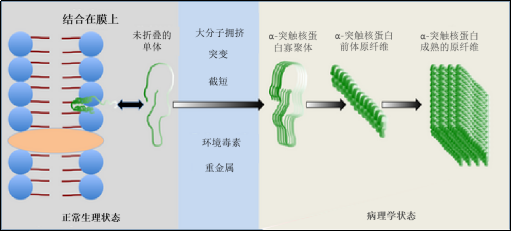
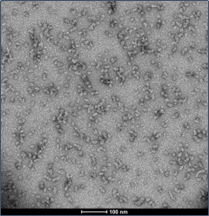
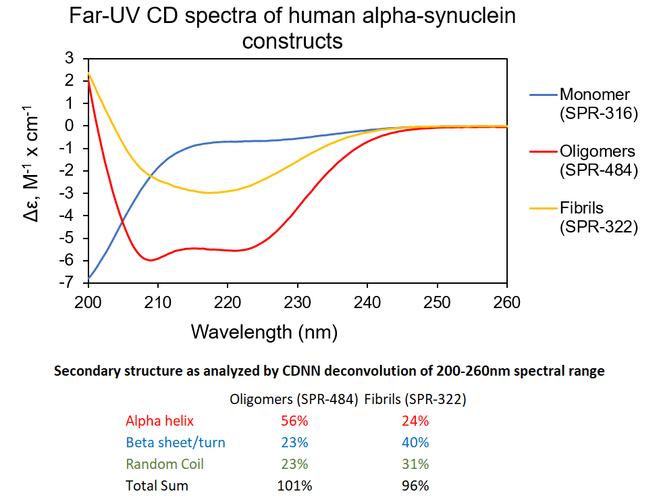
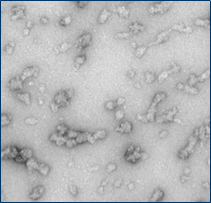
| Alpha 突触核蛋白寡聚体 |
|
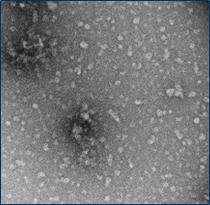
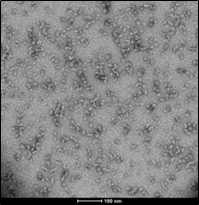
与不溶性原纤维相比,寡聚体是小的(25-30 nm)球状可溶结构。它们是与帕金森病相关的有毒聚集体,在结构上与原纤维不同。
负染色(铀酰酸)的电子显微镜图显示了Alpha 突触核蛋白的寡聚体结构,左侧为用多巴胺处理的alpha 突触核蛋白寡聚体 (目录号 SPR-466),中间为EGCG处理的 (目录号 SPR-469) ,右侧为动态学稳定的寡聚体 (目录号 SPR-484).
|
 |
 |
 |
| 来源: EM performed at U. of British Columbia |
来源: EM performed at U. of British Columbia |
来源: EM performed at University of Toront |
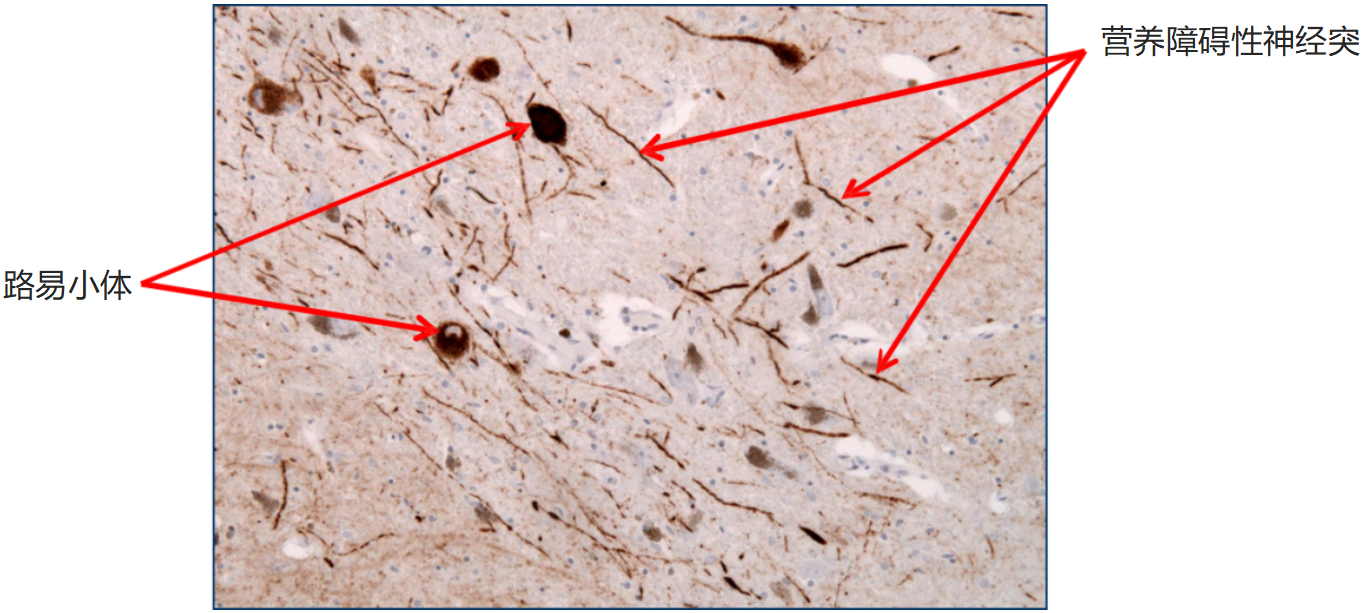
| Alpha 突触核蛋白毒性 |
|
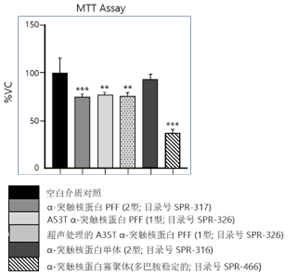
100 µg/ml 的各种 α-突触核蛋白对原代小鼠皮质神经元的毒性测试,一式四份:
孵育 24 小时后进行 MTT 测定(左)和 LDH 释放测定(右)。
|
 |
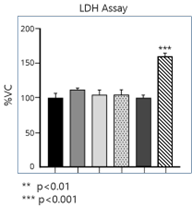 |
| 寡聚体诱发的神经元毒性明显高于原纤维 |
来源: performed at QPS Austria GmbH
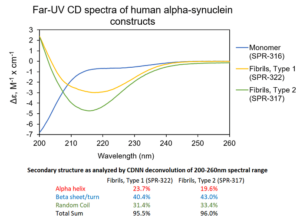
| ATTO 594 标记的原纤维也有聚集活 |
| ATTO594 标记的 (目录号 SPR-322-A594) 人 1型 Alpha 突触核蛋白PFF |
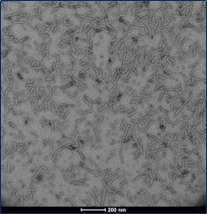 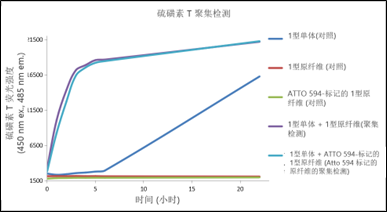 |
| ATTO 594 标记不会显著影响目录号 SPR-322 的聚集能力 |
|
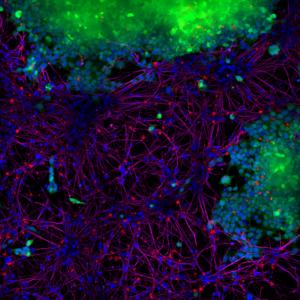
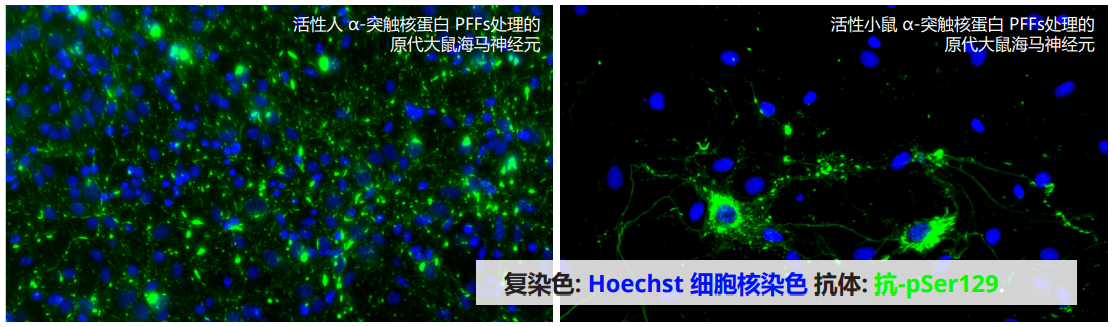
ATTO 594 PFF 诱发人神经元中的病理现象
|
|
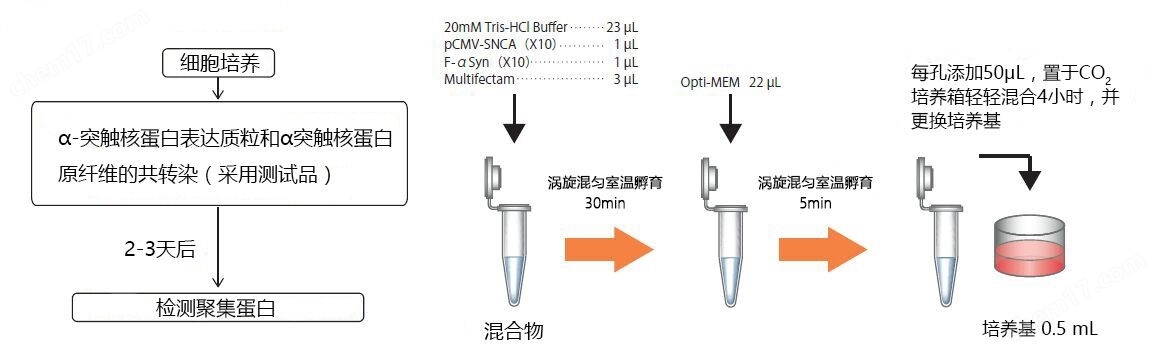
神经元培养试剂盒: 预分化的混合神经元 (血细胞iPSC;) 每孔4000个细胞。
|
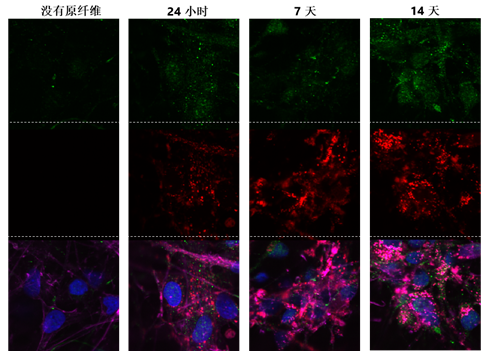 |
|
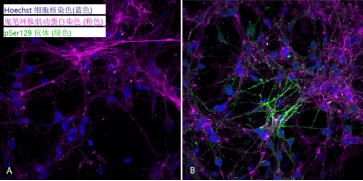
细胞染色:
上: pSer129 α –syn 染色 (Alpha 突触核蛋白抗体, StressMarq 目录号 SMC-600), 绿色
中: ATTO 594 染色, 红色
下: 以上两者复合图, 外加肌动蛋白 (粉色) 和DNA (蓝色) 染色.
来源: ICC human iPSCs; CellState Biosciences, USA
|
| 与 Cellectricon (瑞典) 的合作项目 |
|
ATTO 标记的 PFF(目录号 SPR-322-A594)被引入微流控系统的第 1 室
|
|
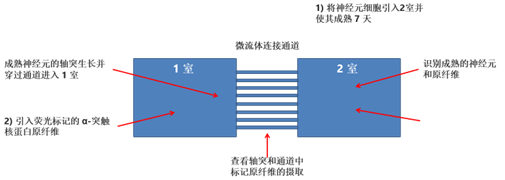

|
| 荧光标记的 α 突触核蛋白原纤维 (目录号 SPR-322-A594) 被第 1 室的神经元摄取,并转运到第 2 室的细胞体中,诱导 α 突触核蛋白磷酸化。 |
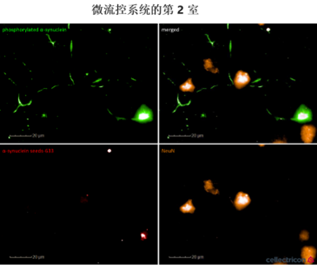 |
|
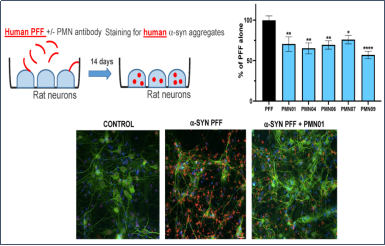
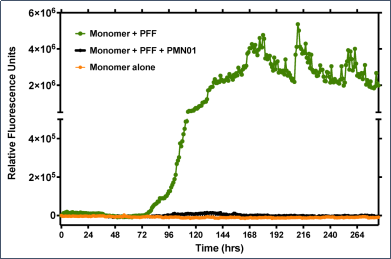
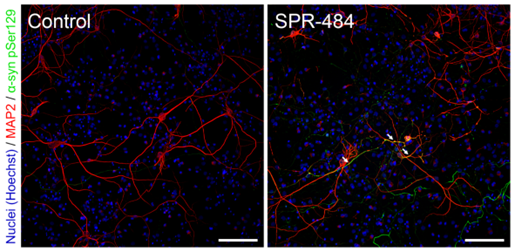
ATTO-594 PFF 诱导大鼠肠神经元中Alpha 突触核蛋白聚集
|
|
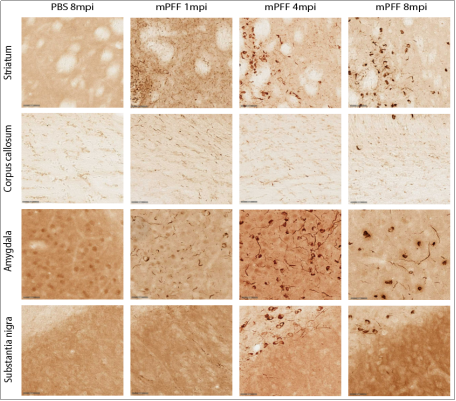
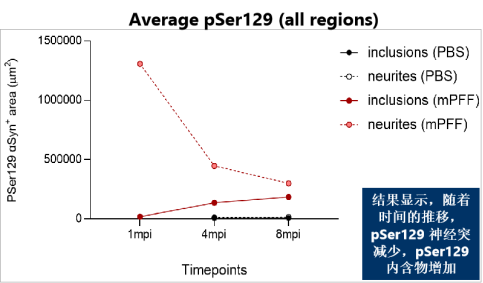
Northeastern大学的研究人员使用 StressMarq 的 ATTO 594 标记的 Alpha 突触核蛋白 PFF(目录号 SPR-322-A594)来研究不同剂量下大鼠肠神经元对荧光标记的 PFF的吸收和保留。将前体原纤维 PD 模型应用于丁酸盐和脂多糖的共同给药组,以模拟局部肠道微生物组的影响。
● 大鼠肠道和皮质神经元中 PFF 的摄取和保留具有显著的剂量依赖性
● 加入了PFF 的肠神经系统 (ENS) 培养物的生长锥形态发生变化
● ENS 克服了 PFF 剂量以保持稳定的活性
|
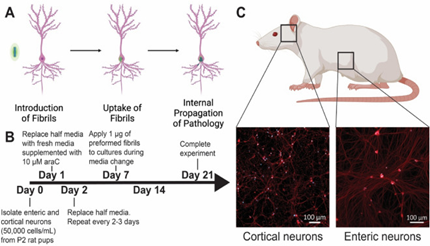 |
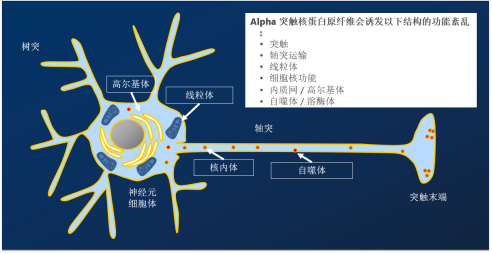
| (A) 理论上的前体原纤维 (PFF) 毒性进展的图示,从 PFF 的引入到神经元的摄取以及内源 α-突触核蛋白 (a-Syn) 的进一步聚集。 (B) 实验设计的时间表。 在整个实验期间,每 2-3 天喂养一次培养物。 (C) 为实验分离出来的神经元群(皮质和肠)的代表性图像,方框圈出的对应的解剖位置。 |
来源: Bindas et al. https://doi.org/10.1038/s41598-022-26543-x
|
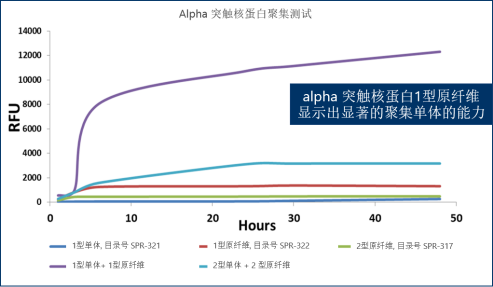
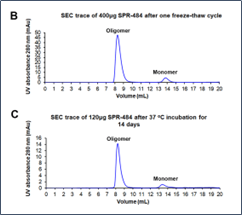
使用α 突触核蛋白单体、PFF 和 动态学稳定的寡聚体
开发的一种新型检测方法
|
|
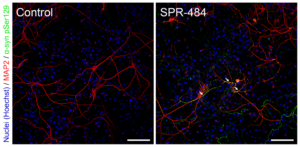
爱丁堡大学的研究人员与 StressMarq Biosciences 合作,使用 α 突触核蛋白单体(目录# SPR-321)、PFF(目录# SPR-322)和动态学稳定的寡聚体(目录# SPR-484)开发了一种定量和表征聚集体的测定方法。这种新技术称为单分子双色聚集体下拉 ( STAPull ),可能是早期诊断中很有前景的工具,因为它能够检测皮摩尔级的寡聚体 α 突触核蛋白,与单色检测相比,灵敏度提高三倍。
● 当两种正交标记的检测抗体靶向相同的表位时检测到寡聚体,从而导致双色共定位。 α突触核蛋白单体产生单色信号。
● 这种新颖的方法可检测到动态学稳定的寡聚体(目录# SPR-484),这些寡聚体最有可能存在于帕金森病的最早阶段。
|
 |
|
STAPull检测ThT阴性α- syn 寡聚体。 A) StressMarq 的人源重组 α-syn 的代表性SiMPull图像,其呈单体、动态学稳定的寡聚体或前体原纤维形式,如图所示。ThT 检测(顶部)或STAPull双色重合(底部)呈现的是相同的视野,插图是方框区域被放大。全视野比例尺为5 μm,插图为2 μm。 B) ThT 斑点平均数的量化,C) (A) 中表示的数据集的每平方微米STAPull重合事件。
参考文献: Saleeb ,R. 等人。 DOI: 10.1126/sciadv.adi7359
|
| Tau-352 (胚胎 0N3R) & Alpha 突触核蛋白共聚集体原纤维 |
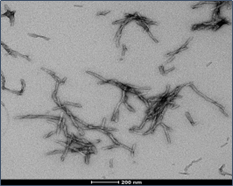 |
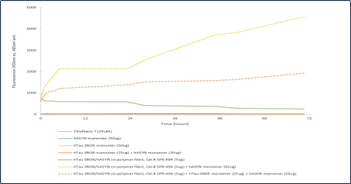 |
| Tau-352 和 Alpha 突触核蛋白共聚体原纤维 (目录号 SPR-494)的电镜 |
胚胎 Tau-352 0N3R & Alpha 突触核蛋白共聚集体原纤维的体外聚集硫磺素T检测 |
| 来源: University of Toronto, Canada |
来源: StressMarq Lab; internal results
|
|
StressMarq 的共聚体原纤维是将单体共孵育在一起之后形成的原纤维,所以该原纤维在单个原纤维中同时含有 Tau 和 Alpha 突触核蛋白。
Tau 0N3R 和 Alpha 突触核蛋白共聚集体原纤维 (目录号 SPR-494) 在72小时内既可以聚集 Alpha 突触核蛋白单体,也可以聚集Alpha 突触核蛋白和 Tau 0N3R 混合的单体。
|
| Tau-441 (2N4R) & Alpha 突触核蛋白共聚集体原纤维 |
 |
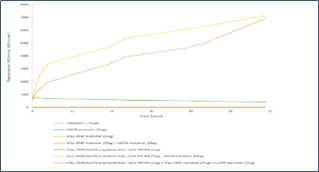 |
| Tau-441 和 Alpha 突触核蛋白共聚集体原纤维 (目录号 SPR-495) 的电镜图 |
Tau 2N4R & Alpha 突触核蛋白共聚集体原纤维的体外聚集硫磺素T检 |
|
来源: University of Toronto, Canada
|
来源: StressMarq Lab; internal results |
|
StressMarq 的共聚体原纤维是将单体共孵育在一起之后形成的原纤维,所以该原纤维在单个原纤维中同时含有 Tau 和 Alpha 突触核蛋白。
Tau 2N4R 和 Alpha 突触核蛋白共聚集体原纤维 (目录号 SPR-495) 在72小时内既可以聚集 Alpha 突触核蛋白单体,也可以聚集Alpha 突触核蛋白和 Tau 2N4R 混合的单体。
|
| Tau & Alpha 突触核蛋白共聚集体原纤维的免疫-TEM |
| 原纤维被吸附到碳涂层铜网格上。 6nm(asyn)和 12nm(tau)信号同时出现在共聚集体原纤维样品的同一原纤维链中(目录号 SPR-494, SPR-495),并且在对照 α-突触核蛋白或 tau 原纤维中未观察到抗体交叉反应。 |
 |
| 网格用含1% BSA 和 0.1% Tween-20 的 PBS 封闭,洗涤,然后依次在封闭缓冲液中用 20 µg/mL 的一抗孵育,洗涤,再在封闭缓冲液中用 20 µg/mL 的二抗孵育,洗涤并用2% 乙酸双氧铀作为负染色。 一抗: 小鼠抗人asyn单克隆抗体(StressMarq SMC-532)和兔抗人tau多克隆抗体(StressMarq SPC-802); 二抗: 6nm 胶体金标记的山羊抗小鼠抗体 (Jackson ImmunoResearch 115-195-146) 和 12nm 胶体金标记的山羊抗兔抗体 (Jackson ImmunoResearch 115-195-146)。 |
StressMarq Alpha 突触核蛋白发表文献
人 Alpha 突触核蛋白前体原纤维 (1型),目录号 SPR-322
Deciphering the role of hsp110 chaperones in diseases of protein misfolding. Yakubu, U. M. (2021) PhD Thesis, University of Texas.
2. Suppression of aggregate and amyloid formation by a novel intrinsically disordered region in metazoan Hsp110 chaperones. Yakubu, U.M. Morano, K.A. (2021) J Biol Chem Jan-Jun 2021;296:100567.
3. Design, Synthesis and Chemically Engineered Graphene Quantum Dot Applications: Contrast Agent for MR Imaging and Targeted Therapeutics on Parkinson’s Treatment. Poonkuzhali, K. et al. (2022) SSRN 4056733.
4. Rational Generation of Monoclonal Antibodies Selective for Pathogenic Forms of Alpha-Synuclein. Gibbs, E. et al. (2022) Biomedicines 10,2168.
5. LRP1 is a neuronal receptor for α-synuclein uptake and spread. Chen, K. et al. (2022) Molecular Neurodegeneration 17(1):57.
6. Granulovacuolar degeneration bodies are independently induced by tau and α-synuclein pathology. Jorge-Oliva, M. et al. (2022) Alzheimer’s Research and Therapy (14)187.
7. Disrupting the α-synuclein- ESCRT interaction with a peptide inhibitor mitigates neurodegeneration in preclinical models of Parkinson’s disease. Nim, S. et al. (2023) Nat Commun 14, 2150.
8. a-Synuclein-dependent increases in PIP5K1γ drive inositol signaling to promote neurotoxicity. Horvath, J. D. et al. (2023) Cell Reports 42, 113244 (Also cited catalog# SPR-480 and SPR-487).
9. Immunization Effects of a Novel α-Synuclein-Based Peptide Epitope Vaccine in Parkinson’s Disease-Associated Pathology. Park, J.S. et al. (2023) Vaccines 11:1820.
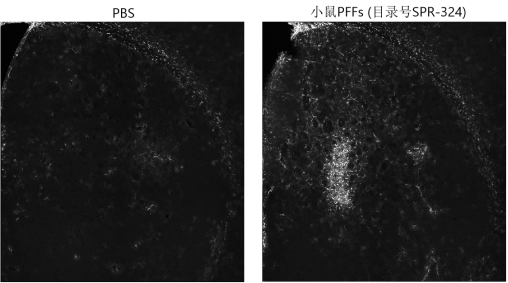
小鼠 Alpha 突触核蛋白前体原纤维 (1型),目录号 SPR-324
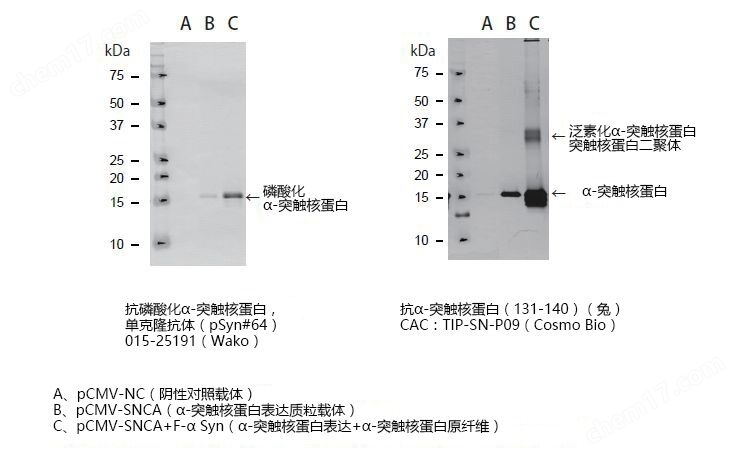
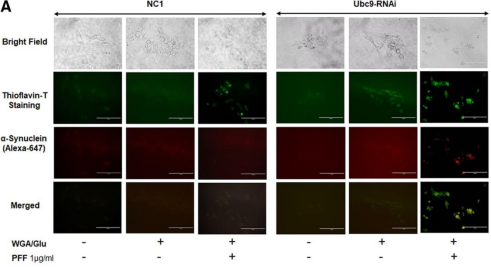
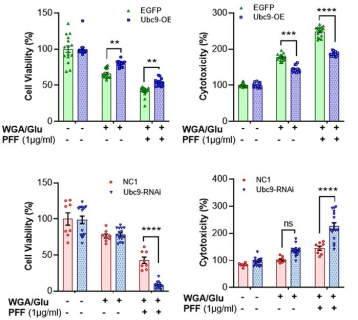
The SUMO conjugase Ubc9 protects Dopaminergic cells from cytotoxicity and enhances the stability of α-synuclein in Parkinson’s disease models. Verma, D.K. et al. (2020) eNeuro 0134-20.2020.
Alpha-Synuclein Preformed Fibrils Induce Cellular Senescence in Parkinson’s Disease Models. Verma, D.K. et al. (2021) Cells 10, 1694.
Heat Shock Protein 70 as a Sex-Skewed Regulator of α-Synucleinopathy.Bhatia, T. N. et al. (2021) Neurotherapeutics Oct;18(4):2541-2564.
Domain-Independent Inhibition of CBP/p300 Attenuates α-Synuclein Aggregation. Hlushchuk, I. et al. (2021) ACS Chemical Neuroscience Jul 7;12(13):2273-2279.
A Novel NOX Inhibitor Treatment Attenuates Parkinson’s Disease-Related Pathology in 小鼠 Models. Ghosh, A. A. et al. (2022) Int J Mol Sci 23, 4262.
Cell Culture Media, Unlike the Presence of Insulin, Affect α-Synuclein Aggregation in Dopaminergic Neurons. Hlushchuk, I. et al. (2022) Biomolecules 12, 563.
Targeted degradation of ⍺-synuclein aggregates in Parkinson’s disease using the AUTOTAC technology. Lee, J. et al. (2023) Mol Neurodegeneration 18, 41.
A Novel NOX Inhibitor Alleviates Parkinson’s Disease Pathology in PFF-Injected Mice. Ofori, K. et al. (2023) preprint.
Genetic and pharmacological reduction of CDK14 mitigates α-synuclein pathology in human neurons and in rodent models of Parkinson’s disease. Parmasad, J.L., et al. (2023) bioRxin preprint.
Identifying Novel Targets and Potential Therapeutics for Parkinson’s Disease. Gosh, A.A et al. (2023) PHD Thesis Delaware State University.
11. Fluorescent Peptide-based Probe for the Detection of Alpha-synuclein Aggregates in the Gut. Sim, R. (2023) bioRxin preprint.
人 Alpha 突触核蛋白前体原纤维: ATTO-594 (1型),目录号 SPR-322-A594
Aggregation of alpha-synuclein in enteric neurons does not impact function in vitro. Bindas, A.J. et al. (2022) Sci Rep 12, 22211.
人 Alpha 突触核蛋白A53T 突变型前体原纤维 (1型),目录号 SPR-326
Environmental enrichment reduced pathological α-Synuclein accumulation by restoring LAMP1 via Reelin in early stage of Parkinson’s disease. Cho, E. (2021) PhD Thesis, Yonsei University.
Reelin Alleviates Mesenchymal Stem Cell Senescence and Reduces Pathological α-Synuclein Expression in an In Vitro Model of Parkinson’s Disease. Cho, E. (2021) Genes 12, 1066.
Reelin protects against pathological alpha-synuclein accumulation and dopaminergic neurodegeneration after environmental enrichment in Parkinson’s disease. Cho, E. et al. (2022) Neurobiology of Disease 175:105898.
人 Alpha 突触核蛋白前体原纤维 (2型), 目录号 SPR-317
Directed Evolution of Antibodies Against Complex Targets. Desai, A. (2021) PhD Thesis, University of Michigan.
Observation of α-Synuclein Preformed Fibrils Interacting with SH-SY5Y Neuroblastoma Cell Membranes Using Scanning Ion Conductance Microscopy. Feng, C. et al. (2022) ACS Chemical Neuroscience. DOI: 101021/acschemneuro.2c00478.
Flow cytometric isolation of drug-like conformational antibodies specific for amyloid fibrils. Desai, A. et al.(2023) bioRxin preprint. (Also cited catalog# SPR-332, SPR-324 & SPR-484)
人 Alpha 突触核蛋白 A53T 突变型蛋白单体 (Type 1), 目录号 SPR-325
Mutant a-synuclein propagates via the lymphatic system of the brain in the monomeric state. Fujita, K. et al. (2023) Cell Reports, 112962.
人 Alpha 突触核蛋白单体 (1型), 目录号 SPR-321
Deciphering the role of hsp110 chaperones in diseases of protein misfolding. Yakubu, U. M. (2021) PhD Thesis, University of Texas.
Suppression of aggregate and amyloid formation by a novel intrinsically disordered region in metazoan Hsp110 chaperones. Yakubu, U.M., Morano, K.A. (2021) J Biol Chem Jan-Jun 2021;296:100567.
人 Alpha 突触核蛋白寡聚体 (动态学稳定的), 目录号 SPR-484
LRP1 is a neuronal receptor for α-synuclein uptake and spread. Chen, K. et al. (2022) Molecular Neurodegeneration 17(1):57.
其他相关产品:
StressMarq的 Alpha 突触核蛋白抗体
|
目标蛋白
|
克隆号
|
宿主
|
适用应用
|
适用物种
|
目录号
|
|
Alpha 突触核蛋白
|
3C11
|
小鼠
|
WB, ICC/IF
|
Hu, Ms, Rt
|
SMC-530
|
|
Alpha 突触核蛋白
|
10H7
|
小鼠
|
WB, ICC/IF
|
Hu, Ms, Rt
|
SMC-531
|
|
Alpha 突触核蛋白
|
3F8
|
小鼠
|
WB, ICC/IF, IHC
|
Hu, Ms, Rt
|
SMC-532
|
|
Alpha 突触核蛋白
|
4F1
|
小鼠
|
WB, ICC/IF, IHC
|
Hu, Ms, Rt
|
SMC-533
|
|
Alpha 突触核蛋白
|
多克隆
|
兔
|
WB, IHC
|
Hu, Ms, Rt
|
SPC-800
|
|
Alpha 突触核蛋白 (pSer129)
|
J18
|
兔
|
WB, IHC
|
Hu, Ms
|
SMC-600
|
|
Alpha 突触核蛋白 (pSer129)
|
多克隆
|
兔
|
WB, ICC/IF, IHC
|
Hu, Ms, Rt
|
SPC-742
|
|
Alpha 突触核蛋白 (pTyr136)
|
多克隆
|
兔
|
WB
|
Hu, Ms, Rt
|
SPC-1435
|
|
Alpha 突触核蛋白 (特异识别聚集体)
|
2F11
|
小鼠
|
WB, DB, IP, IHC, ICC/IF, ImmunoGold 胶体金标记
|
Hu, Ms
|
SMC-617
|
总 结
● 多种α突触核蛋白聚集体可诱发疾病
● StressMarq 研发了一系列 α 突触核蛋白,包括: 两种类型的人源 α 突触核蛋白 PFF; A53T 突变型原纤维; N-乙酰化原纤维;小鼠和大鼠 PFF;未成熟的原纤维;动态学稳定的寡聚体;盐酸多巴胺稳定的寡聚体、EGCG 稳定寡聚体、tau 和 α 突触核蛋白共聚集体原纤维
● 一些 PFF 由相同的起始单体原料制成,在 EM 下看起来形态相似,但它们是在不同的条件下聚集生产的PFF
● 不同的α突触核蛋白形式具有明显不同的神经元和生理活性
● 单体、寡聚体、原纤维和纤丝α突触核蛋白都与帕金森病有关.
● StressMarq 提供各种工具用于突触核蛋白病研究
更多详情请联系Stressmarq中国代理商——上海金畔生物