肌萎缩侧索硬化症的致病基因—野生型SOD1
超氧化物歧化酶(SOD)家族酶的功能是保护细胞免受活性氧的侵害,特别是通过将超氧化物自由基(O2·-)转化为分子氧(O2)和过氧化氢(H2O2)。它包括SOD1,一种含铜和锌的同型二聚体,几乎只存在于细胞胞质空间内;SOD2,线粒体内的含锰四聚体;以及SOD3,一种主要存在于细胞外基质中的含铜和锌的四聚体。SOD1是第一个被了解的家族成员,已经被证实与肌萎缩侧索硬化症(ALS)有关,ALS是一种严重的运动神经元疾病,以大脑和脊髓中的运动神经元进行性退化为特征。目前还没有有效的治疗方法,肌萎缩性侧索硬化症在发病后2 – 5年内就会达到瘫痪和死亡的顶峰,这凸显了SOD1作为潜在治疗靶点的重要性。
SOD1在ALS中的作用是什么?
约90%的ALS病例为散发性(SALS),其余10%为家族性(FALS)。然而,这两种疾病的临床相似性长期以来表明它们具有共同的致病途径和/或涉及相似的毒性因素3,4。1993年,在13个不同的FALS家族中发现了11个不同的SOD1错义突变,现在我们知道SOD1就是这样一个因素。自那以后,在ALS患者中发现了超过150个SOD1突变(包括点突变和由于过早终止导致的蛋白截断),占所有FALS病例的20-25%和SALS病例的一小部分3,6。重要的是,ALS相关的SOD1突变可诱导蛋白质在轴突中错误折叠和聚集,从而导致神经元细胞死亡。因此,SOD1已成为ALS研究领域中研究最广泛的基因之一,并被认为是一个有希望的治疗干预靶点。
突变型SOD1被认为驱动ALS的发病和发展,而野生型(WT) SOD1蛋白被认为是疾病的重要调节因子。支持这一假说的主要发现包括:非遗传型干扰,如金属消耗、氧化和蛋白四级结构的破坏会诱导WT型SOD1发生错误折叠。研究发现从SALS患者脊髓中免疫纯化的WT SOD1可以以类似于FALS相关的突变体的方式抑制基于驱动蛋白的快速轴突运输;数据显示在转基因小鼠中高表达的WT型人源SOD1加上其它各种突变形式(A4V、G85R、G93A、T116X或L126Z)的人源蛋白会加速病程3,4,6。此外,一组SALS患者的脑脊液(CSF)的ELISA评估发现,WT SOD1在所有检查的病例中都存在错误折叠;虽然SALS患者的脑脊液(CSF)样本对培养的运动神经元样NSC-34细胞表现出明显的毒性,但这种效应可以通过免疫沉淀去除错误折叠的WT SOD1蛋白来改善2。
用于野生型SOD1研究的产品
Stressmarq为研究野生型SOD1的研究人员提供了多种产品。这些包括我们的人源重组SOD1蛋白单体(SPR -435)和我们的人源重组SOD1蛋白预形成的原纤维(SPR -470),它们可以用于研究体外SOD1的聚集。
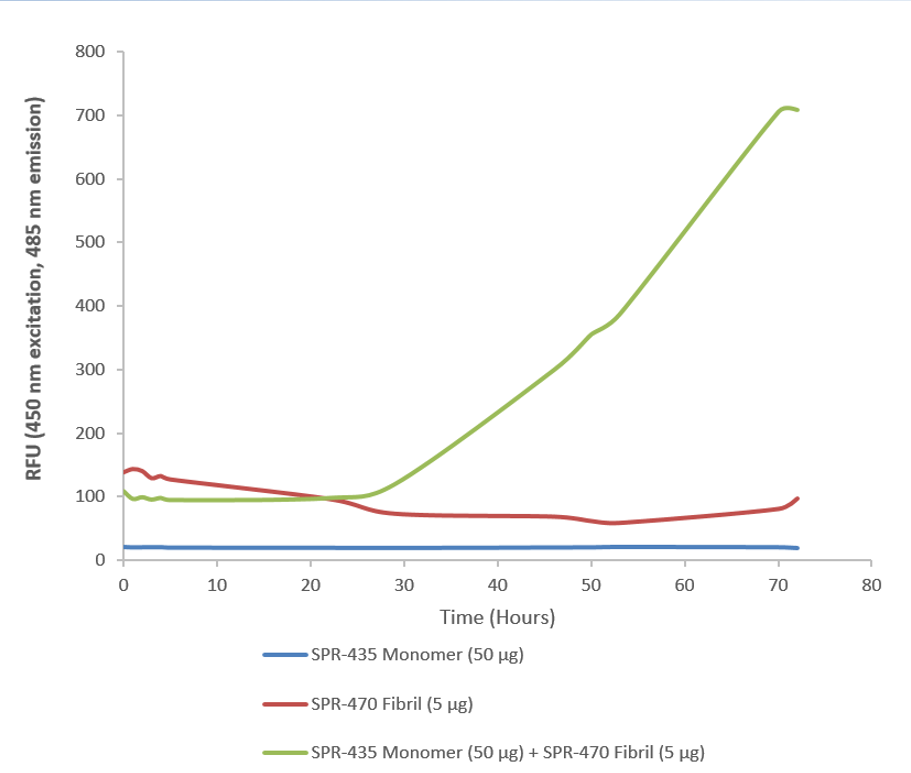
ThT assay of SOD1 pre-formed fibrils (SPR-470) combined with SOD1 monomers (SPR-435).
TEM of human SOD1 pre-formed fibrils (PFFs) (SPR-470)
其他的关于SOD1产品的信息,包括实验步骤,储存,常见问题可以参考StressMarq官网。
参考文献
1. Superoxide dismutase multigene family: a comparison of the CuZn-SOD (SOD1), Mn-SOD (SOD2), and EC-SOD (SOD3) gene structures, evolution, and expression, Zelko IN et al, Free Radic Biol Med. 2002 Aug 1;33(3):337-49
2. Wild-type Cu/Zn-superoxide dismutase is misfolded in cerebrospinal fluid of sporadic amyotrophic lateral sclerosis, Tokuda E et al, Mol Neurodegener. 2019 Nov 19;14(1):42
3. An emerging role for misfolded wild-type SOD1 in sporadic ALS pathogenesis, Rotunno MS and Bosco DA, Front Cell Neurosci. 2013 Dec 16;7:253
4. Wild-type and mutant SOD1 share an aberrant conformation and a common pathogenic pathway in ALS, Bosco DA et al, Nat Neurosci. 2010 Nov;13(11):1396-403
5. Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis, Rosen DR et al, Nature. 1993 Mar 4;362(6415):59-62
6. An examination of wild-type SOD1 in modulating the toxicity and aggregation of ALS-associated mutant SOD1, Prudencio M et al, Hum Mol Genet. 2010 Dec 15;19(24):4774-89
详情请咨询StressMarq全国代理-上海金畔生物科技

