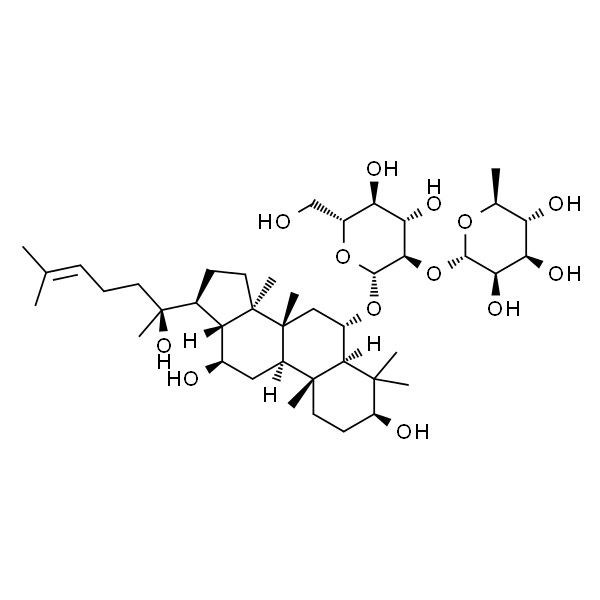
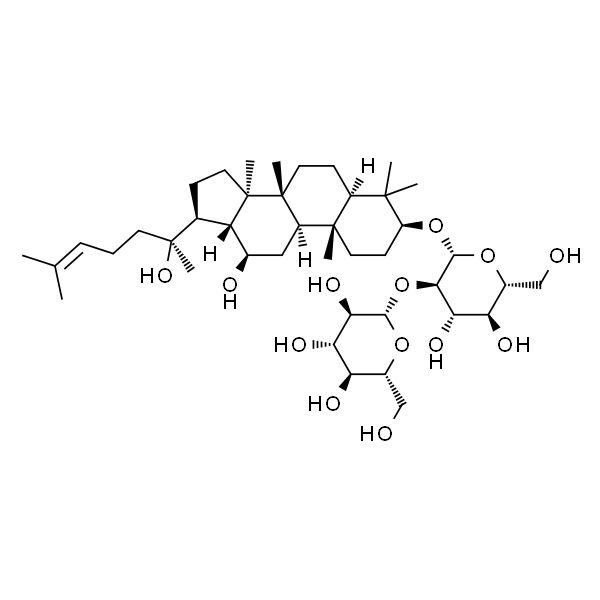
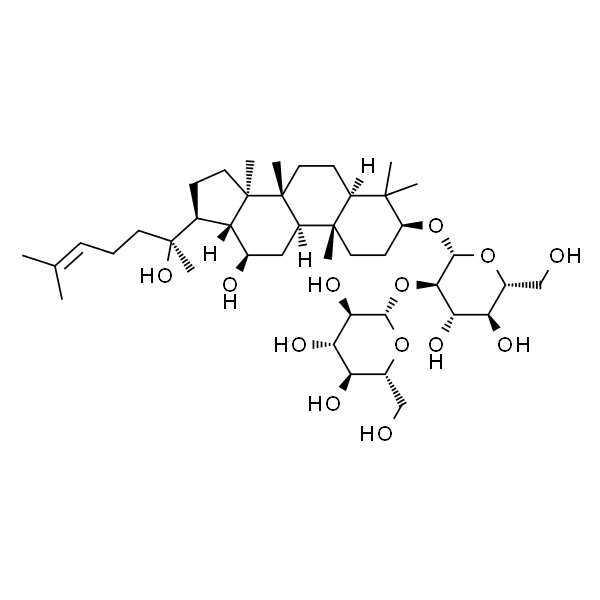
Ginsenoside Rg1 人参皂苷Rg1
| EC | EINECS 244-989-9 |
| MDL | MFCD00210293 |
| 别名 | Panaxoside Rg1; ? Panaxoside A; ? Ginsenoside A2; ? Sanchinoside C1; ? Sanchinoside Rg1 |
| CAS | 22427-39-0 |
| 分子式 | C42H72O14 |
| 分子量 | 801.01 |
| 纯度 | HPLC≥98% |
| 单位 | 瓶 |
| 生物活性 | Ginsenoside Rg1 是人参的主要活性成分之一。Ginsenoside Rg1 通过降低大脑 Aβ 水平来发挥作用。Ginsenoside Rg1 减少 NF-κB 核易位。[1-3] |
| In Vitro | 人参皂苷Rg1促进人牙髓细胞(hDPCs)的增殖和分化。 hDPCs在人参皂苷Rg1中的增殖能力显着增强(p <0.05),尤其是在人参皂苷Rg1(5μM)组中。与对照组相比,诱导组,人参皂苷Rg1组及其联合组的DSPP和DMP1的ALP活性和基因表达均增加(p <0.05)[3]。在由脂多糖(LPS)刺激的RAW264.7细胞中,p-IκBα和p-p65的水平显着高于对照,并且PPAR-γ水平显着降低。用Rg1体外处理抑制IκBα磷酸化,减少NF-κB核转位并上调PPAR-γ表达[2]。 |
| In Vivo | 在佐剂诱导的关节炎(AIA)大鼠的发炎关节中,p-IκBα和p-p65的水平显着高于对照,并且PPAR-γ水平显着降低。人参皂甙Rg1体内抑制可抑制IκBα磷酸化,减少NF-κB核转位,上调PPAR-γ表达[2]。与阿尔茨海默病(AD)模型组相比,人参皂苷Rg1(G-Rg1)和人参皂苷Rg2(G-Rg2)在最后两个训练日减少逃避潜伏期(p <0.05)。在空间探索测试中,在AD模型组小鼠中,在目标象限中花费的总时间和完全越过平台的先前位置的小鼠的数量分别明显更短和更低(正常对照组小鼠)( p <0.01),通过用人参皂苷Rg1和人参皂苷Rg2(人参皂苷Rg1,p <0.01;人参皂苷Rg2,p <0.05)处理而逆转的趋势。用人参皂苷Rg1和人参皂苷Rg2治疗有效地改善了由于AD导致的小鼠的认知功能。人参皂苷Rg1和人参皂苷Rg2减少APP / PS1小鼠中的Aβ1-42积累。在人参皂苷Rg1和人参皂苷Rg2处理的小鼠中,在APP / PS1小鼠中观察到的病理学异常逐渐改善。清晰的核仁和浅棕色,稀疏分散的Aβ沉积物是可见的[1]。 |
| SMILES | [H][C@]12C(C)(C)[C@@H](O)CC[C@]1(C)[C@]3([H])[C@@]([C@@](CC[C@]4([H])[C@@](CC/C=C(C)/C)(C)O[C@@H]5O[C@H](CO)[C@@H](O)[C@H](O)[C@H]5O)(C)[C@]4([H])[C@H](O)C3)(C)C[C@@H]2O[C@]6([H])O[C@H](CO)[C@@H](O)[C@H](O)[C@H]6O |
| 靶点 | Amyloid-β |
| 动物实验 | 小鼠[1]使用体重20±2g的雄性APP/PS1小鼠和体重20±2g的雄性C57BL/6J小鼠。将动物保持在空气动物中心中,温度为23±2℃,相对湿度为50±10%,具有自然的光 – 暗循环。食物和水可随意提供。适应1周后,将小鼠分成4组(每组n = 10):正常对照组,AD模型组,人参皂苷Rg1组和人参皂苷Rg2组。根据浓度 – 反应曲线,人参皂苷Rg1和人参皂苷Rg2组中的小鼠每天腹膜内注射人参皂苷Rg1和人参皂苷Rg2(30mg/kg),溶于盐水中。用等剂量盐水(0.9%w/v)处理AD模型组(APP/PS1小鼠)和正常对照组(C57BL/6J非转基因同窝小鼠)中的小鼠。在脑代谢物分析之前,将所有小鼠处理1个月。 |
| 细胞实验 | 将hDPC与不同浓度的人参皂苷Rg1(0.1,0.5,2.5,5,10和20μM)一起温育。人参皂甙Rg1对hDPCs增殖能力的影响通过成纤维细胞集落形成试验,MTT试验和流式细胞术评估细胞周期。设计对照组,成骨诱导组,人参皂苷Rg1(5μM)组和联合组,碱性磷酸酶(ALP)活性和FQ-PCR检测牙本质涎磷蛋白(DSPP)和牙本质基质蛋白1(DMP1)的基因表达。进行评估hDPCs的分化[3]。 |
| 数据来源文献 | [1]. Li N, et al. A UPLC/MS-based metabolomics investigation of the protective effect of ginsenosides Rg1 and Rg2 in mice with Alzheimer’s disease. J Ginseng Res. 2016 Jan;40(1):9-17.
[2]. Zhang L, et al. Ginsenoside Rg1 attenuates adjuvant-induced arthritis in rats via modulation of PPAR-γ/NF-κB signal pathway. Oncotarget. 2017 Jul 24;8(33):55384-55393. [3]. Wang P, et al. Effect of ginsenoside Rg1 on proliferation and differentiation of human dental pulp cells in vitro. Aust Dent J. 2012 Jun;57(2):157-65 |
| 规格 | 5mg 10mg 10mM*1mL (in DMSO) 50mg |
通过降低大脑 Aβ 水平来发挥作用。Ginsenoside Rg1 减少 NF-κB 核易位。